- Автор Alex Aldridge [email protected].
- Public 2023-12-17 13:44.
- Акыркы өзгөртүү 2025-06-01 07:37.
Биринчи жана экинчи тартиптеги реакциялардын ортосундагы негизги айырма биринчи тартиптеги реакциялардын ылдамдыгы ылдамдык теңдемесинде реагенттин концентрациясынын биринчи даражасына көз каранды, ал эми экинчи тартиптеги реакциялардын ылдамдыгы концентрациянын экинчи даражасына көз каранды. тарифтик теңдемедеги термин.
Реакциянын тартиби ылдамдык мыйзам теңдемесинде реагенттин концентрациялары көтөрүлгөн күчтөрдүн суммасы. Бул аныктамага ылайык реакциялардын бир нече формалары бар; нөл тартиптеги реакциялар (бул реакциялар реакцияга кирүүчү заттардын концентрациясына көз каранды эмес), биринчи жана экинчи тартиптеги реакциялар.
Биринчи тартиптеги реакциялар кандай?
Биринчи тартиптеги реакциялар - бул реакциянын ылдамдыгы реакцияга катышкан реагенттердин биринин молярдык концентрациясына көз каранды болгон химиялык реакциялар. Демек, реакциянын тартиби үчүн жогорудагы аныктамага ылайык, ылдамдык мыйзам теңдемесинде реагенттин концентрациялары көтөрүлгөн даражалардын суммасы ар дайым 1 болот. Бул реакцияларга бир эле реагент катыша алат. Анда ошол реагенттин концентрациясы реакциянын ылдамдыгын аныктайт. Бирок кээде бул реакцияларга бирден көп реактивдер катышса, алардын бири реакциянын ылдамдыгын аныктайт.
Бул түшүнүктү түшүнүү үчүн бир мисал карап көрөлү. N2O5 ажыратуу реакциясында NO2 жана O түзөт 2 газдар продукт катары. Анын бир гана реагент бар болгондуктан, реакцияны жана ылдамдык теңдемесин төмөнкүдөй жаза алабыз.
2N2O5(g) → 4NO2(g) + O 2(g)
Баа=k[N2O5(g)]m
Бул жерде k - бул реакциянын ылдамдыгы константасы жана m - реакциянын тартиби. Демек, эксперименталдык аныктоолордон m мааниси 1. Ошентип, бул биринчи тартиптеги реакция.
Экинчи тартиптеги реакциялар деген эмне?
Экинчи тартиптеги реакциялар - бул реакциянын ылдамдыгы реакцияга кирген эки реагенттин молярдык концентрациясына же реакцияга катышкан бир реагенттин экинчи даражасына көз каранды болгон химиялык реакциялар. Демек, реакциянын тартиби үчүн жогорудагы аныктамага ылайык, ылдамдык мыйзам теңдемесинде реагенттин концентрациялары көтөрүлгөн даражалардын суммасы ар дайым 2 болот. Эгерде эки реагент бар болсо, реакциянын ылдамдыгы биринчи даражага көз каранды болот. ар бир реагенттин концентрациясынын.
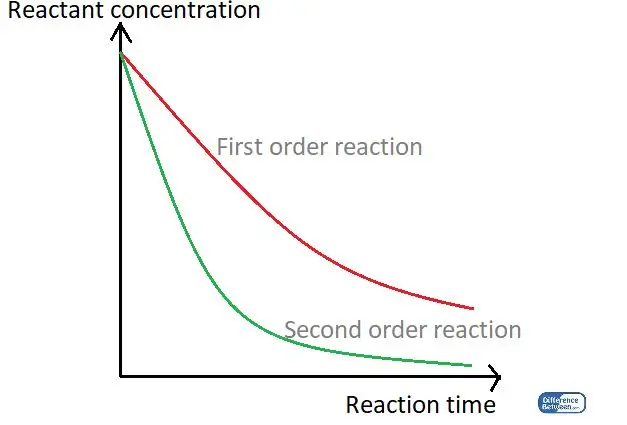
01-сүрөт: Реакция убактысын жана реагенттин концентрациясын колдонуу менен реакциянын тартибинин эки түрүн салыштырган график.
Эгерде реакцияга кирүүчү заттын концентрациясын 2 эсеге жогорулатсак (эгер ылдамдык теңдемесинде эки реагент бар болсо), анда реакциянын ылдамдыгы 4 эсе өсөт. Мисалы, төмөнкү реакцияны карап көрөлү.
2A → P
Бул жерде А реагент, ал эми P продукт. Эгер бул экинчи тартиптеги реакция болсо, бул реакциянын ылдамдык теңдемеси төмөнкүдөй болот.
Баа=k[A]2
Бирок төмөнкүдөй эки башка реагент менен реакция үчүн;
A + B → P
Баа=k[A]1[B]1
Биринчи жана экинчи тартиптеги реакциялардын ортосунда кандай айырма бар?
Биринчи тартиптеги реакциялар - бул реакциянын ылдамдыгы реакцияга катышкан реагенттердин биринин молярдык концентрациясына көз каранды болгон химиялык реакциялар. Демек, реакцияга кирүүчү заттын концентрациясын 2 эсеге жогорулатсак, реакциянын ылдамдыгы 2 эсеге өсөт. Экинчи тартиптеги реакциялар - реакциянын ылдамдыгы реакцияга катышкан эки реагенттин молярдык концентрациясына же бир реагенттин экинчи даражасына көз каранды болгон химиялык реакциялар. Демек, реакцияга кирүүчү заттын концентрациясын 2 эсеге жогорулатсак, реакциянын ылдамдыгы 4 эсеге өсөт. Төмөнкү инфографика биринчи жана экинчи даражадагы реакциялардын ортосундагы айырманы таблица түрүндө көрсөтөт.

Кыскача маалымат - Биринчи жана Экинчи Тартип Реакциялары
Реакциянын жүрүү тартиби боюнча үч негизги түрү бар; нөл, биринчи жана экинчи тартиптеги реакциялар. Биринчи жана экинчи тартиптеги реакциялардын ортосундагы негизги айырма, биринчи тартиптеги реакциянын ылдамдыгы ылдамдык теңдемесинде реагент концентрациясынын биринчи даражасына көз каранды, ал эми экинчи тартиптеги реакциянын ылдамдыгы концентрация мөөнөтүнүн экинчи даражасына көз каранды. чен теңдемеси.






